En esta segunda parte sobre la gestión de centros de inseminación artificial porcina, vamos a analizar el procedimiento de cálculo de concentración espermática, y los factores que puede afectar a una valoración correcta.
Concentración espermática
El cálculo de la concentración espermática del eyaculado (número de espermatozoides/ml) es un valor muy importante, ya que, junto al volumen del eyaculado, dependerá el número de dosis a realizar. Sin duda, este es el punto más crítico y controvertido de todo el proceso, ya que la variabilidad entre los distintos aparatos de medida es considerable, y si no controlamos su correcta calibración de forma continua, podremos caer en el grave error de preparar dosis con una concentración inferior a la deseada, o por el contrario aumentar la concentración de las dosis por encima de unos valores innecesarios para obtener una fertilidad adecuada, disminuyendo de este modo el potencial productivo del semental. Actualmente, los CIAP necesitan producir al menos dos tipos de dosis, ya sea para inseminación cervical (dosis de 80-100 ml) o dosis para inseminación post-cervical (dosis de 30-60 ml), por lo que la precisión en el análisis de la concentración es esencial, principalmente para la inseminación post-cervical, ya que se utilizará un menor número de espermatozoides (Bortolozzo et al. 2015).
Los métodos analíticos para su cálculo pueden ser manuales o automáticos. Los hematocitómetros (método manual: cámara de Bürker, Neubauer o Thoma entre otras) (figura 1a) se han visto reemplazados por aparatos electrónicos (método automático) (figura 1b), principalmente colorímetros, debido a su mayor rapidez de cálculo (Camus et al. 2011).
Independientemente del método empleado para el cálculo de la concentración, pueden producirse errores durante la medición, bien por errores en el método de preparación de las muestras seminales o por fallos de los aparatos de medida. Para reducir la posibilidad de cometer errores de cálculo, se deben calibrar los aparatos de manera periódica. Curiosamente, para calibrar estos aparatos electrónicos se siguen utilizando los métodos manuales tal como son los hematocitómetros. Estas cámaras de recuento no son más que unos dispositivos de cristal, los cuales cuentan con una cámara con un volumen conocido donde se introduce la muestra seminal a analizar. La precisión que nos ofrecen no va a depender más que de la superficie de recuento que realicemos sobre ellos. A mayor campo de recuento, y mayor repetición de los ensayos, menor será el error obtenido. En la figura 2 se compara la concentración espermática (nº espermatozoides x 106/ml) de muestras seminales de diferentes eyaculados (1-14) realizadas entre un colorímetro y la cámara de Bürker.
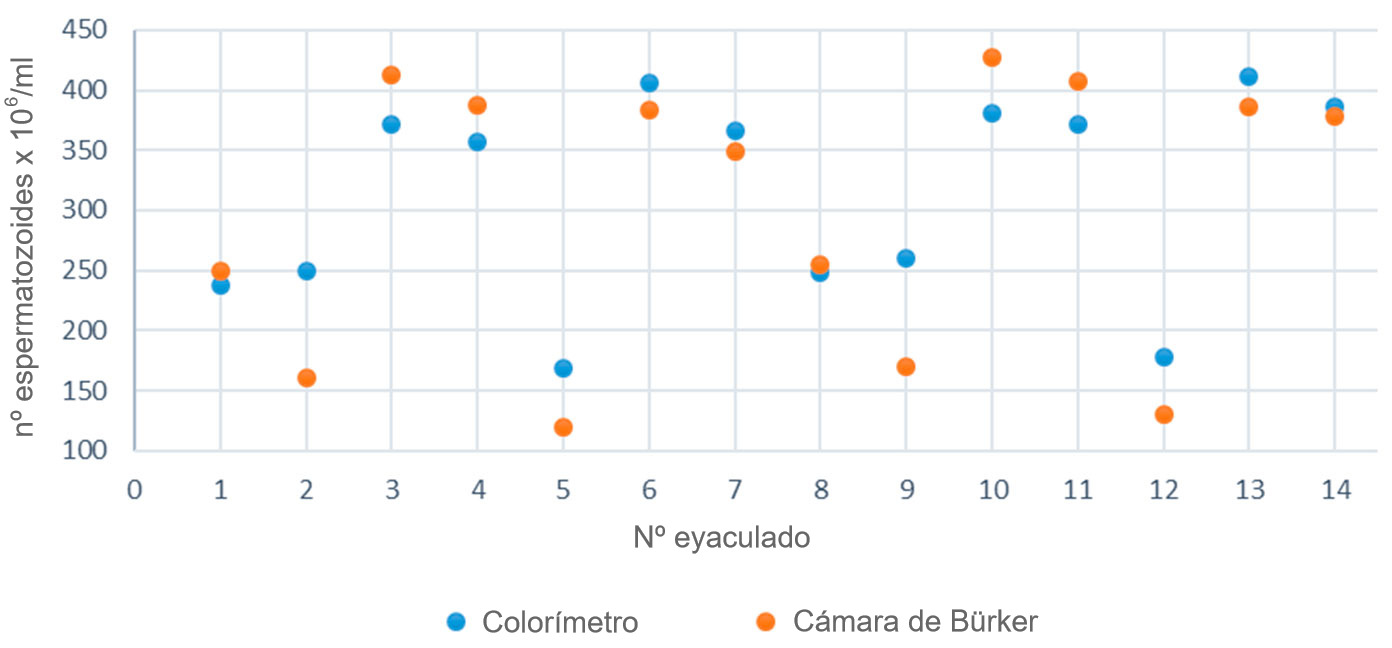
Figura 2. Comparación de la concentración espermática calculada entre un colorímetro y la cámara de Bürker para una misma muestra de semen.
En el proceso utilizado para realizar el cálculo de concentración, son varios los puntos que pueden afectar a una correcta medida. Por ejemplo, en el momento de extraer la muestra del eyaculado para su valoración, es muy importante homogenizar correctamente todo el contenido en el vaso de recogida, ya que la velocidad de sedimentación de los espermatozoides es elevada. Si el tiempo transcurrido desde la extracción hasta el momento del análisis es superior a 10 minutos, la concentración espermática de la zona donde se realiza la toma de muestra con la pipeta, que es en la parte superior del eyaculado, tendrá una concentración inferior a la real.
Por otro lado, en la figura 3 comparamos el resultado de la concentración espermática eliminando o no los restos de semen que quedan en la parte externa de la punta de la pipeta automática. Al introducir la punta de la pipeta en el eyaculado para tomar la muestra seminal, queda adherido a las paredes exteriores de la punta de plástico de la pipeta, y una vez se vierte el contenido de la pipeta en la cubeta del colorímetro, este volumen externo se suma a la concentración añadida para la lectura de la concentración. Los resultados obtenidos mostraron que la diferencia en la concentración espermática entre limpiar y no limpiar la parte externa de la punta de la pipeta para eliminar el exceso de líquido seminal podría llegar a ser de hasta un 20% (figura 3).
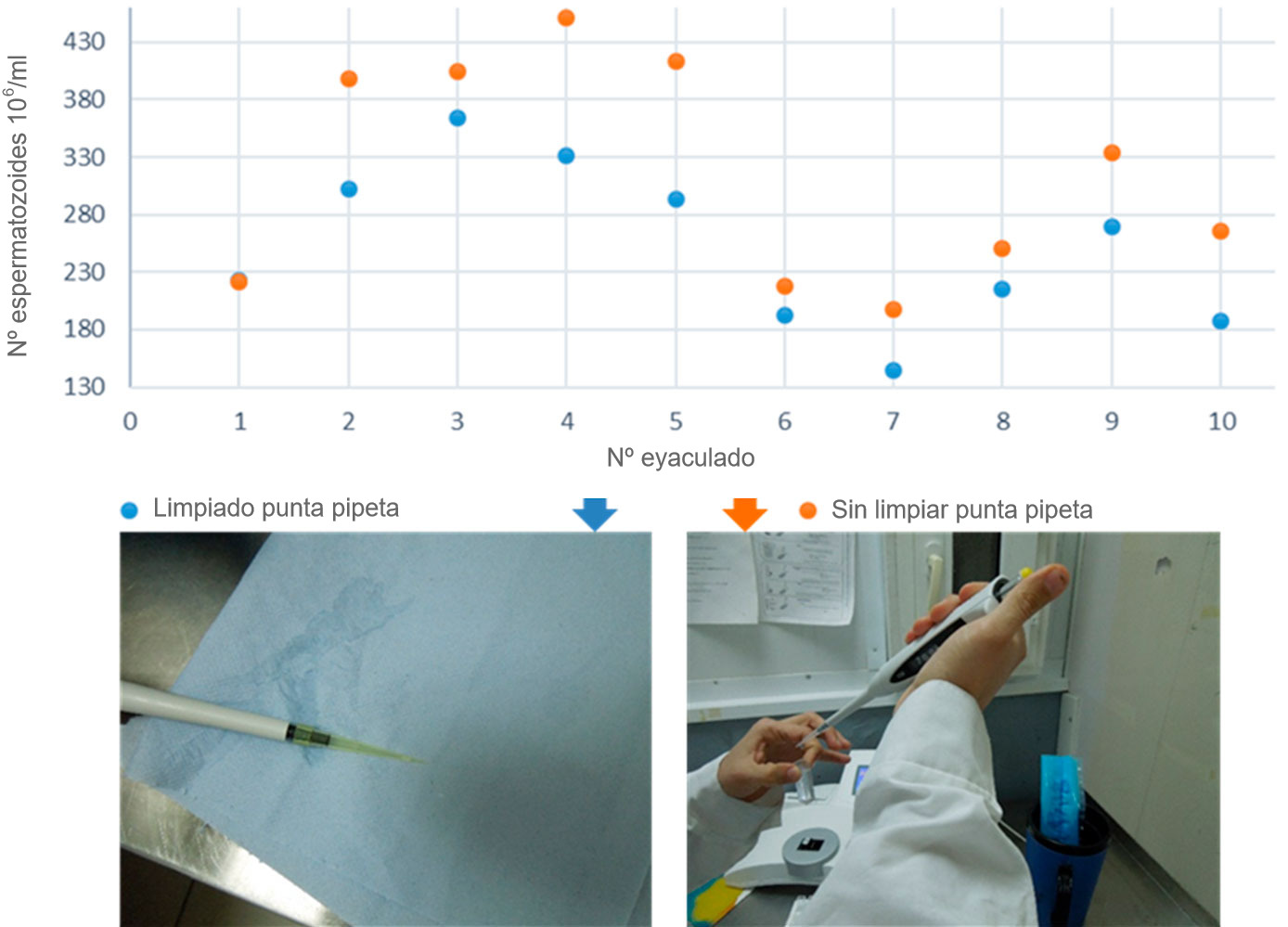
Figura 3. Comparación de la concentración espermática cuando se limpia el semen adherido a las paredes de la punta de la pipeta y cuándo no.
El objetivo final del cálculo de la concentración espermática no es otro que el de garantizar que las dosis seminales comercializadas por el CIAP contengan la concentración espermática mínima exigible a cada dosis, sin ningún error. Un método sencillo que nos puede ayudar a valorar la concentración espermática del semen ya diluido, y antes de envasarlo, es volver a valorar la concentración, pero esta vez con un instrumento distinto de medida, y de esta forma evaluar la diferencia de concentración entre la deseada y la real. Este proceso puede ser muy rápido de aplicar utilizando aparatos de lectura directa sobre la dilución seminal preparada (figura 1c).
Conclusiones
En conclusión, garantizar un máximo control de calidad de las dosis seminales elaboradas en nuestros CIAP, pasa sin duda por disponer de un protocolo de calidad que incluya puntos de control tan importantes como los vistos en estos artículos (tabla 1). En el principio del proceso de elaboración de dosis seminales se encuentra el buen manejo de los verracos que aumente su productividad y calidad seminal, así como disponer de las instalaciones y manejo necesario para realizar una correcta recogida y procesado del semen. Una vez en el laboratorio todo el proceso de elaboración estará encaminado a valorar con precisión los parámetros de calidad del eyaculado, y con ello realizar dosis seminales con la máxima calidad, que aseguren una alta fertilidad tras la IA. Hoy en día, las metodologías y protocolos de IA se centran cada vez más en el uso de dosis con un reducido número de espermatozoides, como es el caso de la inseminación post-cervical o el uso de la IA a tiempo fijo (Ulguim et al. 2016); en cualquiera de estos casos, el número de espermatozoides utilizados durante la IA se está viendo reducido, por lo que la importancia en una correcta preparación de las dosis de inseminación es de vital importancia para mantener unos datos de fertilidad en las granjas adecuados.
Tabla 1. Puntos de control para un correcto manejo y preparación de las dosis seminales.
PUNTOS CRÍTICOS
DESCRIPCIÓN
Temperatura dosis
– Mezclar semen con el diluyente a una temperatura ligeramente inferior a la extracción (33ºC)
– Mantener dosis ~100 minutos para alcanzar temperatura ambiente (24ºC)
– Conservar dosis a 15ºC
Calidad seminal
– Realizar una valoración inicial de la calidad seminal (motilidad y morfología)
– Controlar/calibrar periódicamente los sistemas automáticos de análisis de motilidad
– Realizar los análisis de manera metódica y sistemática
Concentración espermática
– Homogeneizar la muestra justo antes del análisis
– Controlar/calibrar periódicamente los sistemas automáticos de medición de la concentración
– Realizar los análisis de manera metódica y sistemática
Fuente: 3tres3




















































